En el universo primigenio, antes de las estrellas, sólo había hidrógeno y helio (tal vez con un poco de litio), sintetizados en el Big Bang. El resto de los elementos se formaron en los hornos estelares. El carbono tiene un estatus especial: su fusión con núcleos de helio (partículas α) conduce al nitrógeno, al oxígeno y finalmente a la química de la vida. Pero formar el carbono no es una tarea fácil.
En 1954 Fred Hoyle descubrió que, después de la fusión de dos partículas α para formar berilio 8, hay una probabilidad finita de que una tercera partícula α se junte a las otras dos en una resonancia de tres cuerpos. Esta resonancia cercana al estado fundamental (ahora llamada estado de Hoyle) normalmente se desintegra, pero a veces dura lo suficiente como para decaer al estado fundamental del 12C. La radiación gamma que revela esta transición se detectó unos años más tarde.
Un grupo germano-americano ha realizado recientemente nuevos cálculos ab initio en redes, incluyendo correcciones de tercer orden en la teoría de campos efectiva quiral, que revelan las configuraciones de menor energía del núcleo 12C. En el estado fundamental, las partículas α mantienen su individualidad, pero se agrupan en un triángulo compacto, lo que parece razonable para obtener la mínima energía.
El estado de Hoyle era más sorprendente, pues las partículas α ni estaban agrupadas de forma compacta ni en una cadena recta. En cambio, formaban una ángulo obtuso abierto, similar a la molécula del agua. Los resultados numéricos encajan bien con los datos experimentales disponibles. Ahora el grupo va a tratar de realizar cálculos en redes de mayor resolución.
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/2/10.1063/PT.3.1874
domingo, 29 de diciembre de 2013
domingo, 22 de diciembre de 2013
Siguiendo la pista al virus Ébola en las células huésped
Cuando un genoma viral atraviesa la membrana de una célula, ésta se ve abocada a replicar el genoma extraño creando las proteínas que constituyen la cubierta del virus (o cápside). Las proteínas de la cápside se ensamblan por sí solas; los genomas replicados se introducen dentro; y los nuevos virus así creados salen violentamente de la célula.
Para reproducirse, los virus se apropian de las fábricas moleculares del huésped. Pero un equipo dirigido por Robert Stahelin (Escuela de Medicina de la Universidad de Indiana y Universidad de Notre Dame, Indiana) ha descubierto algo diferente. El virus letal del Ébola aprovecha otra molécula totalmente diferente que se halla dentro de las células: la actina.
La actina se polimeriza formando filamentos que conforman la estructura interna de la célula. Su presencia en las cápsides del Ébola ya se había detectado antes, pero su papel no estaba claro. Para resolver el misterio, Stahelin y su equipo crearon células mutantes cuyas moléculas de actina se etiquetaron con mCherry, una proteína fluorescente roja. También crearon proteínas mutantes del Ébola que, cuando se expresan, etiquetan una proteína de la cápside llamada VP40 con EGFP, una proteína fluorescente verde.
Usando microscopía confocal y rastreo de una sola partícula, el equipo de Stahelin halló que los filamentos de actina no solo atraían al VP40, sino que dirigían el movimiento de las proteínas por la célula. Además, introduciendo en las células una toxina que inhibe la polimerización de la actina, descubrieron que los filamentos de actina fomentan la construcción de la cápside.
Dado que la actina se encuentra en todas las células con núcleo, no parece sorprendente que un virus evolucionara para aprovechar esta molécula. Pero ahora que se ha revelado la dependencia que el Ébola tiene de la actina, tenemos una pista más para hallar un tratamiento para esta enfermedad que generalmente mata al 90% de sus víctimas.
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/1/10.1063/PT.3.1847
Para reproducirse, los virus se apropian de las fábricas moleculares del huésped. Pero un equipo dirigido por Robert Stahelin (Escuela de Medicina de la Universidad de Indiana y Universidad de Notre Dame, Indiana) ha descubierto algo diferente. El virus letal del Ébola aprovecha otra molécula totalmente diferente que se halla dentro de las células: la actina.
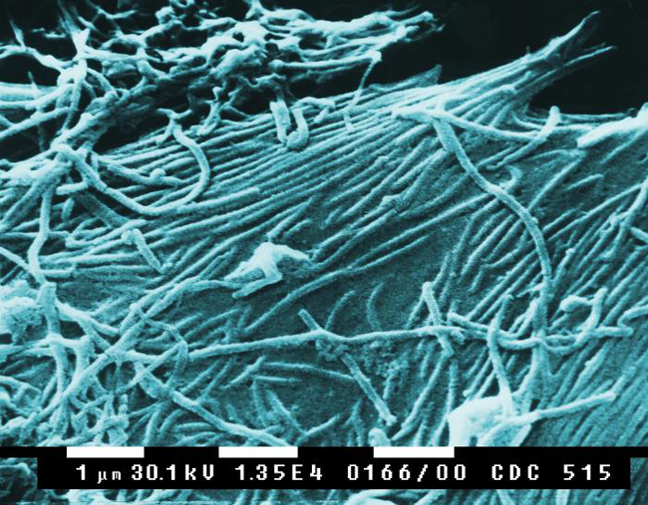 |
| Partículas del virus Ébola vistas a través de un microscopio electrónico de barrido. [Imagen: Charting the Path of the Deadly Ebola Virus in Central Africa. PLoS Biol 3/11/2005: e403 doi:10.1371/journal.pbio.0030403] |
La actina se polimeriza formando filamentos que conforman la estructura interna de la célula. Su presencia en las cápsides del Ébola ya se había detectado antes, pero su papel no estaba claro. Para resolver el misterio, Stahelin y su equipo crearon células mutantes cuyas moléculas de actina se etiquetaron con mCherry, una proteína fluorescente roja. También crearon proteínas mutantes del Ébola que, cuando se expresan, etiquetan una proteína de la cápside llamada VP40 con EGFP, una proteína fluorescente verde.
Usando microscopía confocal y rastreo de una sola partícula, el equipo de Stahelin halló que los filamentos de actina no solo atraían al VP40, sino que dirigían el movimiento de las proteínas por la célula. Además, introduciendo en las células una toxina que inhibe la polimerización de la actina, descubrieron que los filamentos de actina fomentan la construcción de la cápside.
Dado que la actina se encuentra en todas las células con núcleo, no parece sorprendente que un virus evolucionara para aprovechar esta molécula. Pero ahora que se ha revelado la dependencia que el Ébola tiene de la actina, tenemos una pista más para hallar un tratamiento para esta enfermedad que generalmente mata al 90% de sus víctimas.
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/1/10.1063/PT.3.1847
domingo, 15 de diciembre de 2013
El esparadrapo que no duele
Los esparadrapos que sujetan a la piel tubos para respirar y otros dispositivos médicos no solo son adhesivos, sino también fuertes. Después de todo, han de resistir tanto el desgaste como las fuerzas de cizalladura entre la piel y el esparadrapo que podrían mover el aparato que está sujeto.
Sin embargo, para los bebés y los pacientes mayores, el propio esparadrapo representa un peligro. Cuando se quita, puede rasgar la piel, provocando molestias y, a veces, dejando una cicatriz o algo peor. En los Estados Unidos, el acto de quitar uno de estos esparadrapos es responsable de 1,5 millones de lesiones anuales.
Para abordar este problema, un equipo bajo la dirección de Jeffrey Karp (Hospital Brigham and Women's y MIT) ha diseñado un esparadrapo que aprovecha los eficaces adhesivos modernos que no irritan la piel y son duraderos, pero que además se pueden despegar sin lesionar la piel.
La innovación consiste en cubrir la capa de refuerzo con un sustrato no adhesivo y después usar un láser para grabar regiones microscópicas en ese material intermedio, de modo que las capas adhesiva y de refuerzo puedan entrar en contacto. Esta técnica permite crear un esparadrapo que distribuye las fuerzas de cizalladura sobre un área grande, pero localiza la tensión cuando se aplican las fuerzas que entran en juego al despegar el esparadrapo.
El resultado es que la capa externa del esparadrapo se despega fácilmente al tirar de él, mientras que la capa adhesiva que queda pegada a la piel se puede quitar con facilidad frotando suavemente. Un buen invento, ¿no crees?
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/1/10.1063/PT.3.1845
Sin embargo, para los bebés y los pacientes mayores, el propio esparadrapo representa un peligro. Cuando se quita, puede rasgar la piel, provocando molestias y, a veces, dejando una cicatriz o algo peor. En los Estados Unidos, el acto de quitar uno de estos esparadrapos es responsable de 1,5 millones de lesiones anuales.
 |
| La capa externa del nuevo esparadrapo se despega fácilmente, dejando atrás la capa adhesiva. (Foto de Bryan Laulicht, tomada de MITnews.) |
La innovación consiste en cubrir la capa de refuerzo con un sustrato no adhesivo y después usar un láser para grabar regiones microscópicas en ese material intermedio, de modo que las capas adhesiva y de refuerzo puedan entrar en contacto. Esta técnica permite crear un esparadrapo que distribuye las fuerzas de cizalladura sobre un área grande, pero localiza la tensión cuando se aplican las fuerzas que entran en juego al despegar el esparadrapo.
El resultado es que la capa externa del esparadrapo se despega fácilmente al tirar de él, mientras que la capa adhesiva que queda pegada a la piel se puede quitar con facilidad frotando suavemente. Un buen invento, ¿no crees?
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/1/10.1063/PT.3.1845
domingo, 8 de diciembre de 2013
¿Partículas con carga fraccionaria? ¿Dónde?
Los quarks tienen cargas fraccionarias ±e/3 y ±2e/3. Pero la fuerza que los une formando los hadrones es tan fuerte que los quarks no pueden encontrarse como partículas libres. Y tampoco se ha visto hasta la fecha ninguna otra partícula con una carga fraccionaria.
No obstante, no existe ningún impedimento teórico obvio para la existencia de partículas libres con carga fraccionaria, mientras sean inmunes a la fuerza nuclear fuerte. En realidad, algunas extensiones del modelo estándar de la teoría de partículas anticipan la existencia de partículas masivas con cargas fraccionarias (FCHAMPs por sus siglas en inglés) sin interacciones fuertes.
Estas extensiones predicen, en función de las supuestas masa y carga de la FCHAMP, el ritmo de producción de pares de FCHAMPs de cargas opuestas en colisiones entre protones de alta energía. La marca distintiva de una FCHAMP sería su pérdida de energía anormalmente baja mediante la ionización de los materiales del detector.
Sin embargo, la colaboración que dirige el gigantesco detector CMS (mostrado en la foto) del Gran Colisionador de Hadrones en el CERN no ha encontrado señales de producción de FCHAMPs en los restos de casi 1014 colisiones p-p durante el año 2011. Cuanto más masiva es la FCHAMP, menor debería ser su ritmo de producción. Dado el resultado nulo, la colaboración asigna un límite inferior a la masa (con un 95% de confianza) de unas 400 masas de protón (mp) si las cargas de la FCHAMP son ±2e/3, y de 260 mp si son ±e/3.
En realidad, las teorías que se tienen en cuenta no limitan las cargas fraccionarias a esos valores (±e/3 y ±2e/3), pero el ritmo de producción aumentaría al aumentar la carga. ¿Será posible algún día encontrar un quark suelto viajando por el espacio? ¿Qué nuevas implicaciones tendría sobre nuestro conocimiento del universo? Solo el tiempo lo dirá.
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/1/10.1063/PT.3.1844
No obstante, no existe ningún impedimento teórico obvio para la existencia de partículas libres con carga fraccionaria, mientras sean inmunes a la fuerza nuclear fuerte. En realidad, algunas extensiones del modelo estándar de la teoría de partículas anticipan la existencia de partículas masivas con cargas fraccionarias (FCHAMPs por sus siglas en inglés) sin interacciones fuertes.
Estas extensiones predicen, en función de las supuestas masa y carga de la FCHAMP, el ritmo de producción de pares de FCHAMPs de cargas opuestas en colisiones entre protones de alta energía. La marca distintiva de una FCHAMP sería su pérdida de energía anormalmente baja mediante la ionización de los materiales del detector.
Sin embargo, la colaboración que dirige el gigantesco detector CMS (mostrado en la foto) del Gran Colisionador de Hadrones en el CERN no ha encontrado señales de producción de FCHAMPs en los restos de casi 1014 colisiones p-p durante el año 2011. Cuanto más masiva es la FCHAMP, menor debería ser su ritmo de producción. Dado el resultado nulo, la colaboración asigna un límite inferior a la masa (con un 95% de confianza) de unas 400 masas de protón (mp) si las cargas de la FCHAMP son ±2e/3, y de 260 mp si son ±e/3.
 |
| Detector CMS del Gran Colisionador de Hadrones en el CERN. [Foto original de Domenico Salvagnin de Legnaro (Italia).] |
_____
Fuente:
http://scitation.aip.org/content/aip/magazine/physicstoday/article/66/1/10.1063/PT.3.1844
domingo, 1 de diciembre de 2013
Escudo contra las pirañas
Existe un pez en el Amazonas que ha desarrollado una defensa de múltiples capas contra la voraz piraña. Unos físicos de materiales de la Universidad de California en Berkeley, bajo la dirección de Robert Ritchie, han estado investigando tal pez. Mediante exámenes microscópicos y pruebas mecánicas han revelado los secretos del arapaima (paiche o pirarucú), uno de los peces de agua dulce más grandes del planeta.
Las escamas del arapaima tienen una cubierta exterior ultradura diseñada para provocar la fractura de los dientes en el punto de penetración. Además, las escamas tienen una forma ondulada que permite desviar la presión a una capa de colágeno más gruesa y más elástica que se halla debajo de las escamas.
El mismo colágeno está dispuesto en capas retorcidas que solapan entre sí. Estas finas capas se llaman lamellae y tienen un grosor de unos 50 nanómetros. Son capaces de deslizarse ligeramente en respuesta a un mordisco, haciendo que la presión se extienda sobre un área mayor.
Este tipo de escamas pueden considerarse un ejemplo de la evolución de un material biológico destinado a una función particular. Están ahí para resistir concretamente el mordisco de las pirañas a través de múltiples niveles de defensa.
El arapaima (Arapaima gigas) es un carnívoro gigante, llegando a alcanzar hasta cuatro metros de longitud y un peso de más de 200 kilos. Su mayor amenaza la tiene en el hombre, que empezó a cazarlo en grandes cantidades para comerlo durante el siglo XIX. Actualmente, su población está significativamente reducida, pero aún resiste.
_____
Fuente:
http://phys.org/news/2013-10-amazon-fish-super-shield-piranhas.html
 |
| Arapaima gigas, acuario del zoo de Colonia. [Foto: © Superbass / CC-BY-SA-3.0 (via Wikimedia Commons)]. |
El mismo colágeno está dispuesto en capas retorcidas que solapan entre sí. Estas finas capas se llaman lamellae y tienen un grosor de unos 50 nanómetros. Son capaces de deslizarse ligeramente en respuesta a un mordisco, haciendo que la presión se extienda sobre un área mayor.
Este tipo de escamas pueden considerarse un ejemplo de la evolución de un material biológico destinado a una función particular. Están ahí para resistir concretamente el mordisco de las pirañas a través de múltiples niveles de defensa.
El arapaima (Arapaima gigas) es un carnívoro gigante, llegando a alcanzar hasta cuatro metros de longitud y un peso de más de 200 kilos. Su mayor amenaza la tiene en el hombre, que empezó a cazarlo en grandes cantidades para comerlo durante el siglo XIX. Actualmente, su población está significativamente reducida, pero aún resiste.
_____
Fuente:
http://phys.org/news/2013-10-amazon-fish-super-shield-piranhas.html
Suscribirse a:
Comentarios (Atom)


