Los galardonados de este año son Eric Betzig (Instituto Médico Howard Hughes), Stefan W. Hell (Instituto Max Planck de Química Biofísica) y William E. Moerner (Universidad Stanford) por su contribución al desarrollo de la microscopía de fluorescencia de superresolución.
El premio Nobel de química de este año gira en torno a cómo el microscopio óptico se convirtió en un nanoscopio, premiando dos técnicas similares pero diferentes que han sido capaces de superar el límite de Abbe.
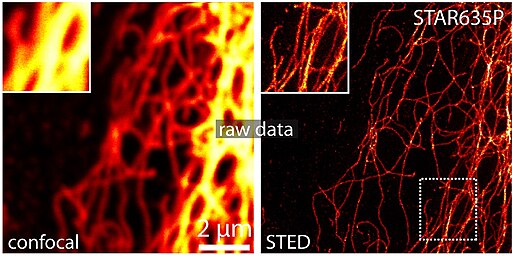
Descrito por primera vez en 1873, el límite de Abbe dice que un microscopio no puede distinguir objetos más pequeños que aproximadamente la mitad de la longitud de onda de la luz usada, que es unos 200 nanómetros para la luz visible. Sin embargo, los mejores microscopios que ahora utilizan los métodos que han ganado el premio Nobel tienen una resolución por debajo de 10 nm.
Hell desarrolló en el año 2000 la microscopía STED (Stimulated Emission Depletion o de reducción por emisión estimulada), que usa dos láseres concéntricos para obtener la imagen de una célula. El láser central excita moléculas fluorescentes de la muestra, mientras que el láser exterior elimina cualquier otra fluorescencia. El detector barre continuamente la muestra, registrando el brillo fluorescente y creando así una imagen con una resolución mayor de 200 nm.
Aunque Betzig y Moerner nunca colaboraron directamente, su trabajo contribuyó decisivamente a poner las bases para la microscopía STED.
Después de que Moerner fuera capaz de detectar una sola molécula fluorescente en 1989, a Betzig se le ocurrió la idea de superponer imágenes de moléculas individuales para crear una imagen completa. El proceso que resumió en un artículo de 1995 describía cómo proyectaba luz de diferentes longitudes de onda sobre una célula para que brillaran distintas moléculas y luego anotaba dónde aparecían los puntos de luz. De este modo, cuando se combinaban todas las imágenes, los puntos formaban un contorno coherente.
No obstante, para obtener una imagen coherente, se necesitarían muchos colores diferentes de moléculas únicas, demasiados para que fuera práctico. Así que realmente no fue hasta 2005, cuando Betzig encontró una proteína específica identificada por Moerner, que la técnica se pudo utilizar. La proteína de Moerner brillaba brevemente y después —de ahí su importancia— se apagaba sola. Una célula con esta proteína se podía iluminar múltiples veces con un láser y cada vez brillaría un conjunto diferente de proteínas, lo que proporcionaría a Betzig la constelación de puntos brillantes que necesitaba para crear una imagen coherente.
Los microscopios electrónicos son capaces desde hace tiempo de obtener la imagen de objetos menores de 200 nm, pero esa técnica daña enormemente la muestra. Por otro lado, no puede observar cosas vivas y los electrones no pueden penetrar mucho dentro de las células. Con la fluorescencia, se puede observar, por ejemplo, la E. coli a superresolución sin tener que matarla, cortarla y someterla a radiación intensa y ultravacío.
¡Felicidades a los tres premiados!
_____
Fuente:
http://www.aps.org/publications/apsnews/201411/nobel.cfm


No hay comentarios:
Publicar un comentario